Philip Morris International a déposé auprès de la Food and Drug Administration une demande d’homologation de “produit du tabac à risque modifié” pour son produit de tabac chauffé sans combustion, l’iQOS.
Philip Morris International (PMI) déposait auprès de la Food and Drug Administration (FDA) une demande d’homologation “produit du tabac à risque modifié“ – Modified Risk Tobacco Product application (MRTPA) pour l’iQOS. Si le processus enclenché en décembre 2016 s’avérait concluant, Altria en charge de la distribution de ce produit du tabac chauffé sur le territoire américain, disposerait alors d’un atout compétitif.
A ce jour, la FDA n’est pas pressée d’homologuer des “risques modifiés”
En novembre 2015, Swedish Match recevait les premières autorisations de commercialisation (PMTA pour PreMarket Tobacco Application en anglais) jamais délivrée par la FDA pour des produits du tabac. Ces PMTA concernaient huit références de SNUS. L’entreprise suédoise avait sollicité dans le même temps une homologation de produits du tabac à risque modifié. Depuis plus d’un an, la FDA semble traîner des pieds et la demande est laissée sans réponse depuis plus d’un an.
A lire : Pourquoi les cigarettiers investissent dans les produits de nouvelle génération ?
L’enjeu de cette homologation est d’afficher la réduction des risques par rapport au tabac fumé et de pouvoir apposer des avertissements comme par exemple celui proposé par Swedish Match : “no tobacco product is safe, but this product presents substantially lower risks to health than cigarettes” (“aucun produit du tabac n’est sans risque, mais ce produit présente substantiellement moins de risque pour la santé que les cigarettes”).

L’autorisation, s’ils obtiennent, leur conférerait un avantage compétitif face aux alternatives à risque réduit, notamment la cigarette électronique, dont les fabricants n’auront pas le droit de revendiquer la réduction du risque sans accord de la FDA. Il est loin d’être certain que les fabricants d’e-liquides engagés dans le processus très onéreux d’autorisation de commercialisation, PMTA, auront les moyens financiers d’engager une MRTPA.
A lire : La grande victoire de Big Tobacco sur la vape aux USA
Un succès commercial au Japon
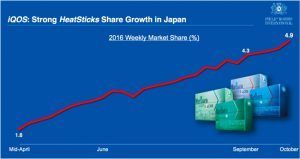
Part de marché de l’iQos au japon. Source Forbes
La commercialisation de l’iQOS a commencé en 2015 sur quelques marchés pilotes comme la Suisse et l’Italie. Selon les données fournies par PMI, le produit rencontrerait un succès spectaculaire au Japon, seul marché où il est disponible à l’échelle nationale.
Au troisième trimestre 2016, la part de marché a progressé à 3,5%, soit une augmentation de 1,3 point par rapport au deuxième trimestre. En outre, la part de marché de la dernière semaine de septembre a atteint 4,3%, et encore plus, 7,3% à Tokyo. Selon les dernières données fournies par Altria, la part de marché hebdomadaire a augmenté à 4,9% en octobre.














